活性化エネルギーって知ってますか
多くの人にとっては化学の授業で習ったような気がするなーという程度かもしれませんね
この活性化エネルギー含む化学反応におけるエネルギーの話ってつながるなーと思った話です
活性化エネルギーとは
活性化エネルギーとはある状態から、別の状態になるために必要なエネルギーです
下の図で、平坦な部分が2つありますが、それが安定な状態です
真ん中にある山の頂上が遷移状態と呼ばれる状態で、両側の安定な状態どっちかに行ける状態です
活性化エネルギーは左の安定状態から右の安定状態に行く反応の場合、遷移状態のエネルギー-左の安定状態のエネルギーということになります
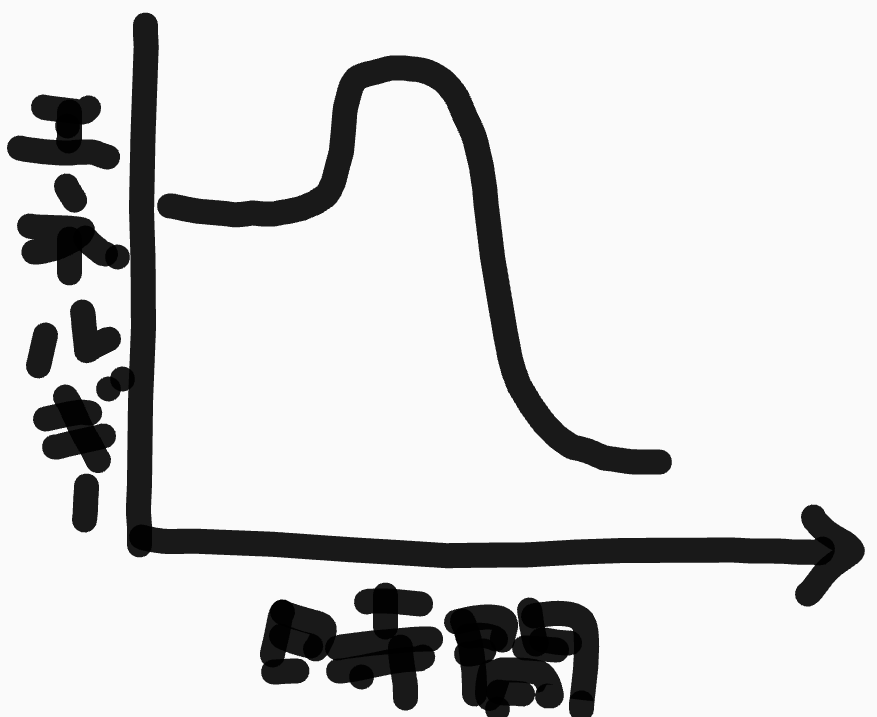
左の安定状態より、右の安定状態の方がエネルギーが低いのでより安定な状態なのでよりそちらに向かって反応が進みやすいんですが、間にある活性化エネルギーの壁によって、右側の状態への反応が進まないという状況です
化学反応を起こさせる場合には、熱を加えて左の状態のエネルギーを高くして、遷移状態とのエネルギー差を小さくするとか触媒を使って、遷移状態の山を低くするということをして山を超えやすくして上げます
現実世界でももっと安定な状態があるのに進めないことってないですか
ここまでが化学反応の話です
では、現実世界でも似たようなことってないですか
もっと楽に仕事を進める方法があるのはわかってるけど、今までのやり方を変えるのは手間がかかるとか、もしくは楽な方法があることに気づいてないこともあるかもしれないですね
ときには少し立ち止まって活性化エネルギーを乗り越える方法を考えてみたり、今より安定な右側の安定状態がどこかにあるんじゃないかと探してみることも必要だと思います
いろんなことに対して、今の状態が安定だ、とか今の状態から変わろうとするには周りが壁に囲まれていてどうすることもできないと思ってることってないでしょうか
一度遷移状態に立ってみれば、今よりいい場所が見つかるかもしれません




コメント